Tablica z charakterystycznymi danymi
Liczba
elektronów: 67
Liczba neutronów: (najbardziej rozpowszechniony, stabilny
izotop): 98
Liczba protonów: 67
Elektroujemność (Allred-Rochow, Pauling):--, 1.2
Stopień utlenienia: +3
Przewodność elektryczna: 12.3*105 1/(m*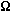 )
)
Gęstość (293 K): 8.78 g/cm3
Temperatura
topnienia: : 1465°C, 1738 K
Temperatura wrzenia: 2600°C, 2873 K
Molowa pojemność cieplna: 27.2 J/(mol*K)
Ciepło topnienia:
17 kJ/mol
Ciepło parowania: 241 kJ/mol
Przewodność cieplna: 16.2 W/(m*K)
