Tablica z charakterystycznymi danymi
Liczba elektronów: 15
Liczba neutronów: 16
Liczba protonów: 15
Elektroujemność (Allred-Rochow, Pauling): 2.06, 2.19
Stopień utlenienia: -3,+3,+4,+5
Przewodność elektryczna: 1*10-9 1/(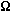 *cm)
*cm)
Gęstość (293 K): 1.82 g/cm3
Temperatura topnienia: 44.3°C, 317.3 K
Temperatura wrzenia: 280°C, 553 K
Ciepło topnienia: 0.657 kJ/mol
Ciepło parowania: 12.129 kJ/mol
Przewodność cieplna: 0.235 W/(m*K)
